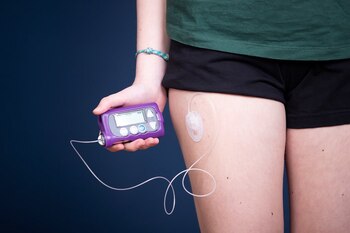
MARTES, 18 de marzo de 2025 (HealthDay News) -- Otras personas podrían tener problemas con la misma bomba de insulina, implante dental o monitor de glucosa que usted usa, y quizá no se enteren de manera oportuna.
Esto se debe a que los fabricantes de dispositivos médicos con frecuencia no informan de inmediato a los reguladores federales sobre los efectos secundarios causados por sus productos, según un estudio reciente.
Alrededor de 3 de cada 10 informes de eventos adversos de dispositivos médicos no llegaron a la Administración de Alimentos y Medicamentos (FDA) de EE. UU. dentro del plazo requerido de 30 días, informaron los investigadores en The BMJ.
"Muchos de los dispositivos con un gran número de informes tardíos fueron cruciales para la atención de los pacientes, incluyendo dispositivos como las bombas de infusión que se usan en los hospitales y los monitores continuos de glucosa que usan los pacientes en entornos ambulatorios", escribió el equipo de investigación dirigido por Alexander Everhart, instructor de la Facultad de Medicina de la Universidad de Washington, en St. Louis.
"Los informes tardíos... podría impedir la identificación de los problemas de seguridad del paciente de manera oportuna", anotaron los investigadores.
El grupo comercial Asociación de Fabricantes de Dispositivos Médicos no respondió a una solicitud de comentarios sobre el nuevo estudio.
Según la ley federal, los fabricantes de dispositivos deben enviar los informes de eventos adversos que reciben de los pacientes a la base de datos de la FDA sobre la Experiencia de los Dispositivos del Fabricante y del Usuario en las Instalaciones (MAUDE) en un plazo de 30 días, señalaron los investigadores en las notas de respaldo.
Para ver si esto está sucediendo, los investigadores analizaron más de 4.4 millones de informes de fabricantes recibidos por la FDA entre septiembre de 2019 y diciembre de 2022, rastreando la diferencia entre la fecha en que un fabricante dijo que fue notificado de un evento y la fecha en que la FDA recibió el informe.
Alrededor de un 71 por ciento de los eventos adversos se notificaron a tiempo, mientras que casi un 5 por ciento se notificaron con hasta seis meses de retraso y un 9 por ciento con más de seis meses de retraso, muestran los resultados.
Alrededor de 1,000 muertes relacionadas con los dispositivos médicos se reportaron tarde, al igual que más de 198,000 lesiones y más de 400,000 fallos de funcionamiento, anotaron los investigadores.
Más del 50 por ciento de los informes recientes provinieron de tres fabricantes con respecto a 13 dispositivos médicos, dijeron los investigadores.
Estos dispositivos incluían bombas de infusión, monitores de glucosa, bombas de insulina e implantes dentales.
"Los retrasos en los informes podrían deberse a que los fabricantes ocultaron a sabiendas información de seguridad importante al público, como se ha informado anteriormente", escribieron los investigadores. "Al mismo tiempo, los retrasos también podrían representar el tiempo requerido para que los fabricantes verifiquen los eventos adversos y recopilen información adicional antes de reportar los eventos a la FDA".
"No obstante, los informes tardíos no están permitidos por las regulaciones existentes, independientemente de la intención", escribieron los investigadores. "La retención de información de seguridad puede causar daños evitables al paciente, dado el papel que la base de datos MAUDE tiene actualmente en la identificación de problemas de seguridad emergentes".
Más información
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) ofrece más información sobre cómo reportar problemas con dispositivos médicos.
FUENTE: BMJ, comunicado de prensa, 12 de marzo de 2025
Investigadores identificaron 9 órganos claves en el desarrollo de enfermedades crónicas
Un estudio británico sugiere que su envejecimiento acelerado está vinculado con trastornos como diabetes, enfermedades cardiovasculares y neurodegenerativas

Caminar diariamente durante 40 minutos puede llegar a prolongar 10 años la vida
Una investigación reciente revela los impactos positivos en la longevidad de este ejercicio simple

¿Por qué aparece la “piel de gallina”?
El frío y otras emociones intensas activan este reflejo provocado por el sistema nervioso. Cómo puede confundirse con el trastorno de la queratosis pilaris

Los trastornos de salud mental en los niños: cómo detectarlos y qué tratamientos existen
El bienestar infantil puede verse afectado por diversos problemas psicológicos que impactan su desarrollo. Abordar estos desafíos requiere reconocer los síntomas e informarse sobre las opciones disponibles para su manejo

Alerta cambio climático: cómo el aumento de las temperaturas puede causar inflamación pulmonar
Una investigación realizada por científicos de Estados Unidos y el Reino Unido identificó el impacto negativo del aire seco en las vías respiratorias. Cómo se realizó el trabajo y por qué advierten sobre una condición que podría afectar a millones de personas en el mundo




